Biofabrikkering av Organ-on-a-Chip-systemer i 2025: Transformasjon av Legemiddeloppdagelse og Personalisert Medisin. Utforsk Gjennombruddene, Markedssurge, og Hva de Neste 5 Årene Har Å By på.
- Sammendrag: Viktige Innsikter og 2025 Høydepunkter
- Markedsoversikt: Definering av Biofabrikkering av Organ-on-a-Chip-systemer
- Markedsstørrelse og Prognoser (2025–2030): Vekstdrivere, Trender, og CAGR Analyse (Estimert CAGR: 22% 2025–2030)
- Teknologilandskap: Fremskritt innen Biofabrikkering, Mikrofluidikk, og Biomaterialer
- Konkurranseanalyse: Ledende Spiller, Oppstartsselskaper, og Strategiske Partnerskap
- Applikasjoner: Legemiddeloppdagelse, Toksikologi, Sykdomsmodellering, og Personalisert Medisin
- Regulatorisk Miljø og Standardiseringsinnsats
- Utfordringer og Barrierer: Tekniske, Kommersiell, og Etiske Hensyn
- Investering og Finansieringstrender: Venturekapital, Tilskudd, og M&A Aktivitet
- Fremtidig Utsikter: Fremvoksende Muligheter, Uoppfylte Behov, og Markedsprognoser frem til 2030
- Kilder og Referanser
Sammendrag: Viktige Innsikter og 2025 Høydepunkter
Biofabrikkering av organ-on-a-chip systemer transformerer raskt biomedisinsk forskning og preklinisk legemiddeltesting ved å muliggjøre opprettelse av mikroingeniørplattformer som nærmer seg menneskelig organfysiologi. I 2025 kjennetegnes feltet av betydelige fremskritt innen mikrofluidisk design, biomaterialinnovasjon, og integrasjon av sanntidssensorer. Disse utviklingene driver økt adopsjon på tvers av farmasøytiske, bioteknologiske og akademiske sektorer, ettersom organ-on-a-chip systemer tilbyr mer prediktive og etiske alternativer til tradisjonelle dyremodeller.
Viktige innsikter for 2025 fremhever konvergensen av 3D bioprinting og mikrofluidikk, som muliggjør presis romlig arrangement av flere celletype og ekstracellulære matriser innen chipplattformer. Dette har ført til fremveksten av multi-organ chips, eller “kropp-på-en-chip” systemer, som letter studiet av komplekse interorganinteraksjoner og systemiske legemiddelresponser. Selskaper som Emulate, Inc. og MIMETAS B.V. er i forkant, kommersialiserer plattformer som støtter høygjennomstrømmingsscreening og sykdomsmodellering med enestående fysiologisk relevans.
En bemerkelsesverdig trend i 2025 er integrasjonen av avanserte biosensorer og AI-drevne analyser, som muliggjør kontinuerlig overvåking av cellulære responser og mer robuste datafortolkninger. Dette akselererer validasjonen av organ-on-a-chip modeller for regulatorisk aksept, med organisasjoner som U.S. Food and Drug Administration (FDA) som aktivt engasjerer seg i samarbeid for å etablere standardiserte protokoller og ytelsesbenchmark.
Bærekraft og skalerbarhet er også i fokus, med produsenter som investerer i automatiserte biofabrikkeringsprosesser og gjenbrukbare chip-materialer for å redusere kostnader og miljøpåvirkning. Utvidelsen av åpne designlager og samarbeidende konsortier, som de støttet av National Institutes of Health (NIH), fremmer innovasjon og akselererer overgangen av organ-on-a-chip-teknologier fra laboratorium til industri.
Oppsummert er 2025 trolig et avgjørende år for biofabrikkering av organ-on-a-chip systemer, preget av teknologisk modning, bredere industriell adopsjon, og økt regulatorisk engasjement. Disse trendene forventes å ytterligere befeste organ-on-a-chip plattformer som essensielle verktøy for legemiddeloppdagelse, toksikologi og personalisert medisin.
Markedsoversikt: Definering av Biofabrikkering av Organ-on-a-Chip-systemer
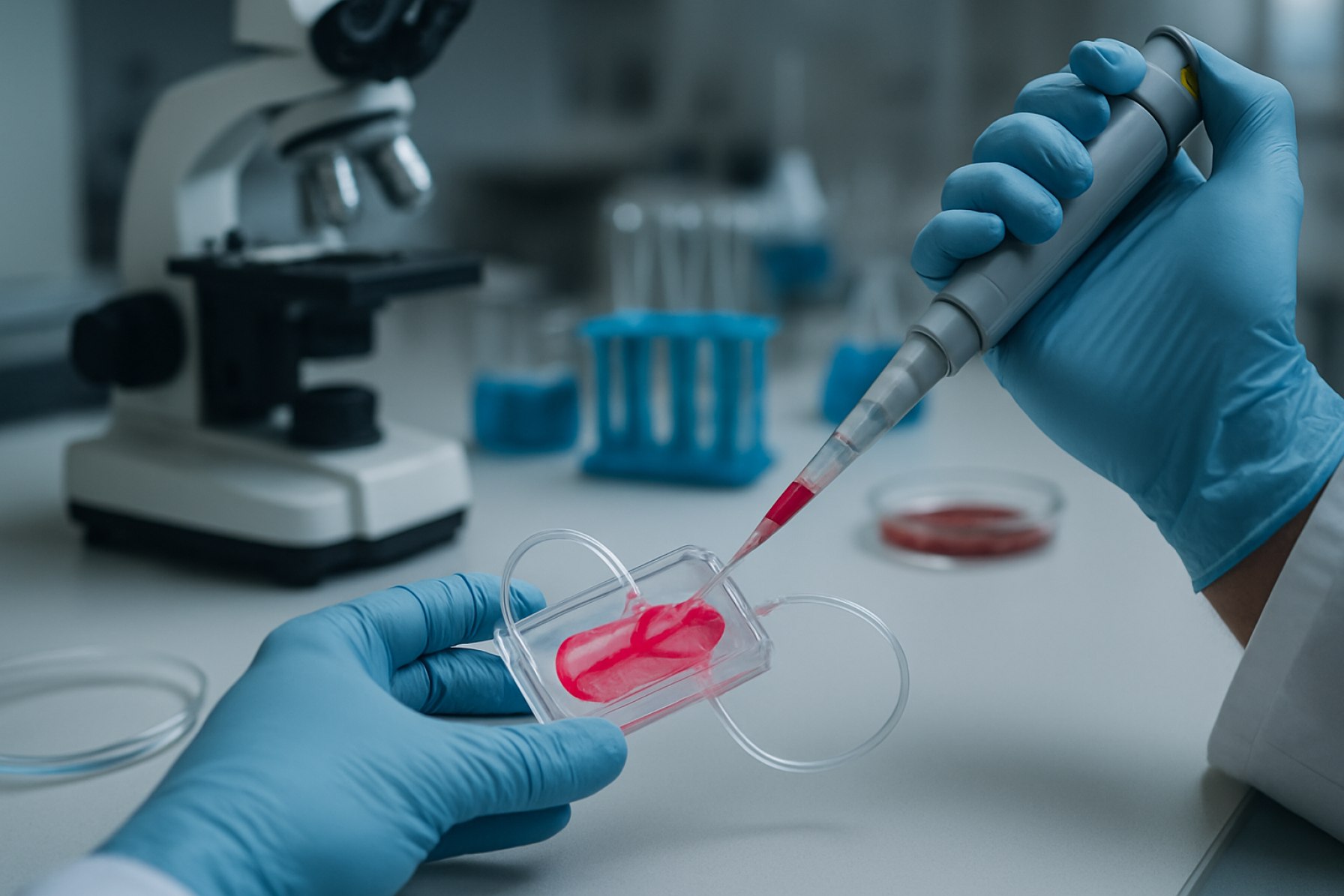
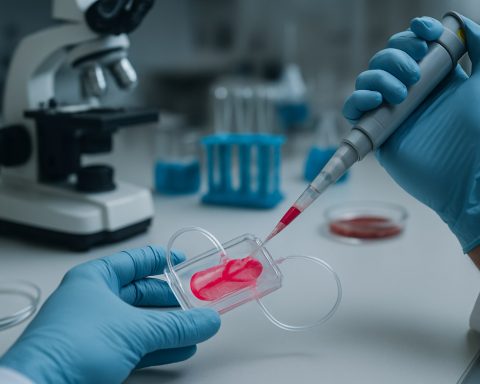
Biofabrikkering av organ-on-a-chip systemer representerer en transformativ sammensmeltning av vevsteknikk, mikrofluidikk, og biomaterialvitenskap. Disse systemene er mikroingeniørte enheter som etterligner de fysiologiske funksjonene til menneskelige organer, og gir et dynamisk og kontrollerbart miljø for å studere organ-nivå responser. I motsetning til tradisjonell cellekultur eller dyremodeller, muliggjør organ-on-a-chip-plattformer mer nøyaktig simulering av menneskelig biologi, som er kritisk for legemiddelutvikling, sykdomsmodellering og toksisitetstesting.
Markedet for biofabrikkerte organ-on-a-chip systemer vokser raskt, drevet av økende etterspørsel etter prediktive, menneskerelevante modeller i farmasøytisk forskning og personalisert medisin. Nøkkelaktører i feltet, som Emulate, Inc. og MIMETAS B.V., fremmer utviklingen og kommersialiseringen av disse plattformene. Deres teknologier integrerer levende celler med mikrofluidiske kanaler, og muliggjør gjenopprettelse av vev-til-vev grensesnitt, mekaniske krefter og biokjemiske gradienter som finnes in vivo.
Biofabrikkeringsmetoder, inkludert 3D bioprinting og mikro-mønstring, er sentrale i utviklingen av organ-on-a-chip-systemer. Disse metodene tillater presist romlig arrangement av flere celletype og ekstracellulære matrise komponenter, og gjenspeiler nært arkitekturen og funksjonen til native vev. For eksempel har TissUse GmbH utviklet multi-organ chips som kobler forskjellige vevstyper, og legger til rette for studier av systemiske interaksjoner og farmakokinetikk.
Regulatoriske byråer og bransjekonsortier, som U.S. Food and Drug Administration (FDA) og European Federation of Pharmaceutical Industries and Associations (EFPIA), anerkjenner i økende grad potensialet til organ-on-a-chip-teknologier for å redusere avhengigheten av dyreforsøk og forbedre effektiviteten av legemiddelutviklingsprosesser. Denne anerkjennelsen fremmer samarbeid og finansieringsinitiativer rettet mot å standardisere og validere disse systemene for bredere adopsjon.
Etter hvert som feltet modnes, er biofabrikkering av organ-on-a-chip-systemer godt posisjonert til å spille en avgjørende rolle i fremtiden for biomedisinsk forskning, og tilbyr skalerbare, reproduserbare, og fysiologisk relevante modeller som bygger bro mellom in vitro studier og kliniske utfall.
Markedsstørrelse og Prognoser (2025–2030): Vekstdrivere, Trender, og CAGR Analyse (Estimert CAGR: 22% 2025–2030)
Det globale markedet for biofabrikkering av organ-on-a-chip systemer er i ferd med å ekspandere betydelig mellom 2025 og 2030, med en estimert årlig vekstrate (CAGR) på 22%. Denne veksten skyldes økende etterspørsel etter fysiologisk relevante in vitro modeller i legemiddeloppdagelse, toksisitets testing, og personlig medisin. Markedets størrelse forventes å nå flere milliarder USD innen 2030, noe som gjenspeiler den raske adopsjonen av avanserte biofabrikkeringsteknikker og integrasjonen av mikrofluidikk, 3D bioprinting, og stamcelleteknologier.
Nøkkeldrivere for vekst inkluderer farmasøytisk industriens behov for å redusere legemiddelutviklingskostnader og tidslinjer, ettersom organ-on-a-chip systemer tilbyr mer prediktive menneske-relevante data sammenlignet med tradisjonelle dyremodeller. Regulatoriske byråer som U.S. Food and Drug Administration støtter i økende grad alternative testmetoder, noe som ytterligere akselererer markedets adopsjon. I tillegg driver veksten av presisjonsmedisin og etterspørselen etter pasient-spesifikke sykdomsmodeller investeringer i biofabrikkering plattformer som er i stand til å gjenskape komplekse vevsarkitekturer og funksjoner.
Teknologiske fremskritt former markedstrendene, med selskaper som Emulate, Inc. og MIMETAS B.V. som pionerer skalerbare organ-on-a-chip-løsninger. Integrasjonen av kunstig intelligens og automatisering i biofabrikkering arbeidsflyt forbedrer gjennomstrømning og reproduserbarhet, og gjør disse systemene mer tilgjengelige for høyinnholdsscreening applikasjoner. Videre fremmer samarbeid mellom akademiske institusjoner, bransjeaktører, og regulatoriske organer innovasjon og standardisering på tvers av sektoren.
Geografisk forventes Nord-Amerika og Europa å opprettholde markedslederskap på grunn av sterk forskningsinfrastruktur og støttende regulatoriske rammeverk. Imidlertid forventes Asia-Stillehavsregionen å oppleve den raskeste veksten, drevet av ekspanderende bioteknologiske sektorer og økt statlig finansiering for livsvitenskapelig forskning.
Oppsummert er markedet for biofabrikkering av organ-on-a-chip systemer satt for betydelig vekst fra 2025 til 2030, drevet av teknologisk innovasjon, regulatorisk støtte, og det presserende behovet for mer prediktive og etiske prekliniske testmodeller. Den estimerte CAGR på 22% understreker sektorens dynamiske utvikling og dens kritiske rolle i å forme fremtiden for biomedisinsk forskning og legemiddelutvikling.
Teknologilandskap: Fremskritt innen Biofabrikkering, Mikrofluidikk, og Biomaterialer
Teknologilandskapet for biofabrikkering av organ-on-a-chip (OoC) systemer i 2025 kjennetegnes av raske fremskritt innen biofabrikkeringsteknikker, mikrofluidisk ingeniørkunst, og utvikling av nye biomaterialer. Disse innovasjonene konvergerer for å skape mer fysiologisk relevante og skalerbare OoC-plattformer, som i økende grad brukes til legemiddeloppdagelse, sykdomsmodellering, og personalisert medisin.
Biofabrikkering metoder som 3D bioprinting og fotolitografi har muliggjort presist romlig arrangement av flere celletype og ekstracellulære matriser innen mikrofluidiske enheter. Dette nivået av kontroll er avgjørende for å gjenskape den komplekse arkitekturen og funksjonen til menneskelige vev. For eksempel har TissUse GmbH utviklet multi-organ chips som integrerer forskjellige vevstyper, noe som muliggjør studier av interorganinteraksjoner under dynamiske strømningsforhold.
Mikrofluidikkteknologi forblir kjernen i OoC-systemer, og gir mulighet for å etterligne de mekaniske og biokjemiske mikroomgivelsene til levende organer. Fremskritt innen mikroproduksjon, som myk litografi og injeksjonsstøping, har forbedret reproduserbarheten og skalerbarheten av chipproduksjon. Selskaper som Emulate, Inc. har kommersialisert mikrofluidiske plattformer som støtter samkultur av humane celler under kontrollert strømningsforhold, skjærstress, og kjemiske gradienter, og som nært simulerer in vivo forhold.
Valg og ingeniør av biomaterialer er kritisk for suksessen til OoC-enheter. Nylige fremskritt innen hydrogelkjemi og overflatemodifikasjon har ført til utviklingen av biomimetiske underlag som støtter celleadhesjon, differensiering, og funksjon. For eksempel bruker MIMETAS B.V. proprietære gelbaserte matriser i sin OrganoPlate® plattform, som muliggjør dannelse av perfuserbare 3D vevsstrukturer uten kunstige membraner.
Integrasjon av sensorer og sanntidsovervåkningsteknologier er en annen betydelig trend. Innebygde biosensorer tillater kontinuerlig vurdering av fysiologiske parametere som pH, oksygen, og metabolsk aktivitet, som forbedrer nytten av OoC-systemer for høyinnholdsscreening og toksisitets testing. Samarbeidsinnsatser mellom akademiske institusjoner og industrien, slik som de som ledes av National Institute of Biomedical Imaging and Bioengineering (NIBIB), akselererer standardiseringen og adopsjonen av disse avanserte plattformene.
Totalt sett driver synergien mellom biofabrikkering, mikrofluidikk, og biomaterialer utviklingen av organ-on-a-chip systemer mot større kompleksitet, pålitelighet, og oversettelsesrelevans i biomedisinsk forskning.
Konkurranseanalyse: Ledende Spillere, Oppstartsselskaper, og Strategiske Partnerskap
Biofabrikkering av organ-on-a-chip (OoC) systemer har raskt utviklet seg til en dynamisk sektor, drevet av sammenhengen mellom mikroingeniørkunst, biomaterialer, og cellebiologi. Det konkurransedyktige landskapet formes av etablerte bioteknologiske firmaer, innovative oppstartsselskaper, og et voksende nettverk av strategiske partnerskap som akselererer forskning og kommersialisering.
Blant de ledende aktørene, skiller Emulate, Inc. seg ut med sitt sterke portefølje av organ-on-a-chip plattformer, inkludert lever-, lunge-, og tarmchips, som er mye brukt i farmasøytisk F&U. MIMETAS er en annen viktig konkurrent, anerkjent for sin OrganoPlate® teknologi som muliggjør høygjennomstrømmingsscreening og kompleks vevsmodellering. CN Bio Innovations har også etablert en sterk tilstedeværelse, spesielt innen lever-on-a-chip systemer for legemiddelmetabolisme og toksisitetsstudier.
Oppstartsselskaper tilfører ny innovasjon til feltet. Tissium og Nortis er bemerkelsesverdige for sitt fokus på vaskulariserte vevsmodeller og mikrofluidiske plattformer. Disse selskapene utnytter avanserte biofabrikkeringsteknikker, som 3D bioprinting og mikrofluidisk mønstring, for å lage mer fysiologisk relevante modeller. Tissium utforsker spesielt integrasjonen av bioaktive materialer for å forbedre vevsfunksjon og reparasjon.
Strategiske partnerskap er et kjennetegn ved veksten i sektoren. Samarbeid mellom teknologi-leverandører og farmasøytiske selskaper, som partnerskapet mellom Emulate, Inc. og F. Hoffmann-La Roche Ltd, har som mål å validere OoC plattformer for preklinisk legemiddeltesting. Akademisk-industri allianser, som de som fremmes av National Institute of Biomedical Imaging and Bioengineering (NIBIB), støtter oversettelsen av akademiske gjennombrudd til kommersielle produkter. I tillegg fremmer konsortier som European Organ-on-Chip Society (EUROoCS) standardisering og kunnskapsutveksling på tvers av sektoren.
Totalt sett er det konkurransedyktige miljøet innen biofabrikkerte organ-on-a-chip systemer preget av rask innovasjon, samarbeid på tvers av sektorer, og fokus på skalerbarhet og regulatorisk aksept. Etter hvert som feltet modnes, vil samspillet mellom etablerte ledere, smidige oppstartsselskaper, og strategiske partnerskap fortsette å forme dets utvikling i 2025 og videre.
Applikasjoner: Legemiddeloppdagelse, Toksikologi, Sykdomsmodellering, og Personalisert Medisin
Biofabrikkering av organ-on-a-chip (OoC) systemer revolusjonerer flere nøkkelområder innen biomedisinsk forskning og helsevesen, spesielt legemiddeloppdagelse, toksikologi, sykdomsmodellering, og personlig medisin. Disse mikroingeniørte enhetene, som replikerer mikroarkitekturen og fysiologiske funksjoner til menneskelige organer, tilbyr enestående muligheter for å studere menneskelig biologi in vitro med høy nøyaktighet.
Innen legemiddeloppdagelse muliggjør OoC-plattformer mer prediktiv preklinisk testing ved å gi menneskerelevante data om legemiddeleffektivitet og farmakokinetikk. I motsetning til tradisjonelle cellekulturer eller dyremodeller, kan disse systemene etterligne organspesifikke responser, noe som reduserer risikoen for feil i legemiddelutviklingen på et senere stadium. For eksempel brukes lever-on-a-chip enheter til å vurdere legemiddelmetabolisme og hepatotoksisitet, mens hjerte-on-a-chip modeller evaluerer kardiotoksiske effekter, og strømlinjeformer utviklingen av legemidler for farmasøytiske selskaper som Pfizer Inc. og Novartis AG.
Toksikologitest er en annen kritisk applikasjon, der OoC-systemer gir en mer nøyaktig vurdering av kjemisk sikkerhet. Regulatoriske organer som U.S. Food and Drug Administration (FDA) er i økende grad interessert i disse teknologiene som alternativer til dyreforsøk, noe som samsvarer med det globale trykket for mer etiske og menneskerelevante sikkerhetsvurderinger.
Sykdomsmodellering drar betydelig nytte av biofabrikkering av OoC-systemer. Ved å inkludere pasientavledede celler, kan forskere gjenskape sykdomsspesifikke mikroomgivelser, noe som muliggjør studiet av komplekse patologi som kreft, nevrodegenerative lidelser, og sjeldne genetiske sykdommer. Denne tilnærmingen støttes av organisasjoner som National Institutes of Health (NIH), som finansierer forskning på OoC-baserte sykdomsmodeller for bedre å forstå sykdomsmekanismer og identifisere nye terapeutiske mål.
Personalisert medisin er kanskje den mest transformative applikasjonen. OoC-enheter laget med celler fra individuelle pasienter tillater testing av tilpassede behandlingsregimer, og forutsier pasient-spesifikke legemiddelresponser og minimerer bivirkninger. Selskaper som Emulate, Inc. er i frontlinjen for å utvikle personlige OoC-plattformer, i samarbeid med helsepersonell for å integrere disse systemene i klinisk beslutningstaking.
Etter hvert som biofabrikkeringsteknikker utvikler seg, forventes integrasjonen av organ-on-a-chip systemer i disse applikasjonene å akselerere, og drive innovasjon i biomedisinsk forskning og bane vei for tryggere, mer effektive terapier.
Regulatorisk Miljø og Standardiseringsinnsats
Det regulatoriske miljøet for biofabrikkering av organ-on-a-chip (OoC) systemer utvikler seg raskt etter hvert som disse teknologiene får stadig større bruksområde i legemiddelutvikling, toksikologi, og sykdomsmodellering. Regulatoriske myndigheter som U.S. Food and Drug Administration (FDA) og European Medicines Agency (EMA) har anerkjent potensialet til OoC-plattformer for å forbedre preklinisk testing ved å tilby mer fysiologisk relevante data sammenlignet med tradisjonelle cellekulturer eller dyremodeller. I 2023 lanserte FDA Alternative Methods Working Group for å utforske integrasjonen av avanserte in vitro modeller, inkludert OoC, inn i regulatorisk vitenskap, noe som signaliserer en endring mot aksept av disse systemene i sikkerhets- og effektvurderinger.
Standardisering er et kritisk fokusområde, da mangel på harmoniserte protokoller og kvalitetsbenchmark kan hindre utbredt adopsjon av OoC-teknologier. Organisasjoner som ASTM International og International Organization for Standardization (ISO) har etablert arbeidsgrupper for å utvikle konsensusstandarder for design, produksjon og validering av OoC-enheter. Disse innsatsene har som mål å sikre reproduserbarhet, interoperabilitet, og datakomparabilitet på tvers av forskjellige plattformer og laboratorier. For eksempel utvikler ASTM’s E55 komité for produksjon av legemidler og biopharmaceuticale produkter aktive retningslinjer for kvalifisering av mikrofyziologiske systemer, som inkluderer OoC-enheter.
Parallelt samarbeider offentlig-private partnerskap og konsortier, som National Center for Advancing Translational Sciences (NCATS) Tissue Chip Program, med regulatoriske organer for å etablere ytelseskriterier og referansematerialer. Disse initiativene letter opprettelsen av standardiserte valideringsdatasett, som er essensielle for regulatoriske innganger og eventuell markedsgodkjenning. Videre gir EMA Innovation Task Force vitenskapelig rådgivning til utviklere av nye OoC-teknologier, og hjelper til med å tilpasse produktutviklingen til regulatoriske forventninger.
Ser vi fremover mot 2025, forventes det regulatoriske landskapet å bli tydeligere, med klarere veier for kvalifisering og aksept av biofabrikkerte OoC-systemer i både farmasøytiske og kliniske applikasjoner. Fortsatt samarbeid mellom industri, akademia, og regulatoriske byråer vil være avgjørende for å takle gjenværende utfordringer relatert til standardisering, validering, og dataintegritet, og dermed akselerere sikker og effektiv integrasjon av OoC-teknologier i biomedisinsk forskning og helsevesen.
Utfordringer og Barrierer: Tekniske, Kommersiell, og Etiske Hensyn
Biofabrikkering av organ-on-a-chip (OoC) systemer representerer en transformativ tilnærming til modellering av menneskelig fysiologi og sykdom, men det står overfor betydelige utfordringer på tvers av tekniske, kommersielle, og etiske domener. Teknisk sett er integrasjonen av flere celletype, presis mikrofluidisk kontroll, og gjenopprettelse av komplekse vevsgrensesnitt formidable hindringer. Å oppnå reproduserbarhet og skalerbarhet i produksjonsprosessen er spesielt vanskelig, da selv små variasjoner i cellekilder eller mikroomgivelsesforhold kan føre til inkonsistente resultater. Videre begrenses langtidsholdbarheten og funksjonaliteten til vev inne i chipene ofte av problemer som næringsdiffusjon, avfallsfjerning, og mekanisk stabilitet. Disse tekniske barrierene krever kontinuerlig innovasjon innen biomaterialer, mikroingeniørkunst, og cellekulturteknikker, som fremhevet av organisasjoner som National Institute of Biomedical Imaging and Bioengineering.
Kommersialisering av OoC-teknologier hindres av høye utviklingskostnader, regulatorisk usikkerhet, og behovet for standardisering. Overgangen fra akademiske prototyper til robuste, brukervennlige produkter egnet for farmasøytiske eller kliniske omgivelser krever betydelig investering i produksjonsinfrastruktur og kvalitetskontroll. Regulatoriske byråer, som U.S. Food and Drug Administration, utvikler fortsatt rammeverk for validering og godkjenning av OoC-systemer, noe som kan bremse markedsadopsjonen. I tillegg kompliserer mangelen på universelt aksepterte standarder for ytelse og interoperabilitet integrasjonen av OoC-plattformer i eksisterende legemiddelutviklingsprosesser.
Etiske hensyn spiller også en kritisk rolle i fremdriften av biofabrikkerte OoC-systemer. Selv om disse teknologiene har potensial til å redusere avhengigheten av dyreforsøk, vedvarer bekymringer knyttet til kildene til humane celler, spesielt når det gjelder bruk av primære vev eller stamceller. Spørsmål om donor samtykke, personvernhensyn, og potensialet for utilsiktet bruk av biologiske materialer må adresseres gjennom gjennomsiktige retningslinjer og tilsyn. Dessuten, etter hvert som OoC-systemer blir mer sofistikerte, oppstår spørsmål om den moralske statusen til konstruerte vev, spesielt i modeller som nærmer seg høyere orden organis kompleksitet eller nevronfunksjon. Etiske retningslinjer fra organer som National Academies of Sciences, Engineering, and Medicine er essensielle for å navigere i disse fremvoksende dilemmaene.
Oppsummert er veien mot utbredt adopsjon av biofabrikkerte organ-on-a-chip systemer i 2025 preget av kontinuerlig teknisk innovasjon, etablering av kommersielle og regulatoriske veier, og nøye vurdering av etiske implikasjoner.
Investering og Finansieringstrender: Venturekapital, Tilskudd, og M&A Aktivitet
Biofabrikkering av organ-on-a-chip (OoC) systemer har dukket opp som en dynamisk sektor innen livsvitenskap, og tiltrekker seg betydelig investering og finansieringsaktivitet de siste årene. Fra og med 2025 vokser interessen for venturekapital (VC) i OoC-oppstartsselskaper, drevet av teknologiens potensial til å revolusjonere legemiddeloppdagelse, toksisitetstesting, og personlig medisin. Ledende VC-selskaper støtter i økende grad selskaper som integrerer avanserte biofabrikkeringsteknikker—som 3D bioprinting og mikrofluidikk—for å lage mer fysiologisk relevante modeller av menneskelige organer. Fremtredende eksempler inkluderer investeringer i oppstartsselskaper som Emulate, Inc. og MIMETAS, som har sikret multi-million dollar finansieringsrunder for å utvide sine plattformer og kommersielle rekkevidde (Emulate, Inc., MIMETAS).
I tillegg til privat investering spiller offentlige og statlige tilskudd en avgjørende rolle i å støtte tidligforskning og utvikling. Byråer som National Institutes of Health og European Commission har lansert dedikerte finansieringskall for organ-on-a-chip og biofabrikkeringprosjekter, og anerkjenner deres potensial til å redusere dyreforsøk og akselerere biomedisinsk innovasjon. Disse tilskuddene retter seg ofte mot samarbeidsprosjekter mellom akademia og industri, og fremmer oversettelsen av nye biofabrikkeringsmetoder til skalerbare OoC-produkter.
Mergers and acquisitions (M&A) aktivitet innen OoC-sektoren har også intensivert, ettersom etablerte livsvitenskaps- og farmasøytiske selskaper søker å integrere organ-on-a-chip-kapasiteter i sine forsknings- og utviklingsprosesser. De siste årene har vi sett strategiske oppkjøp av innovative OoC-oppstartsselskaper av store aktører som CN Bio Innovations og InSphero AG, som har til hensikt å utvide sine teknologiporteføljer og akselerere produktutviklingen. Disse M&A-bevegelsene er ofte motivert av ønsket om å få tilgang til proprietære biofabrikkerings teknologier, spesialisert kompetanse, og etablerte kundennettverk.
Totalt sett er investeringslandskapet for biofabrikkerte organ-on-a-chip systemer i 2025 preget av robust VC-finansiering, betydelige offentlige tilskudd, og økende M&A-aktivitet. Denne tillstrømningen av kapital og strategisk interesse forventes å drive frem ytterligere innovasjon, oppskalering, og kommersialisering, posisjonere OoC-teknologier som en hjørnestein i neste generasjons biomedisinsk forskning og legemiddelutvikling.
Fremtidig Utsikter: Fremvoksende Muligheter, Uoppfylte Behov, og Markedsprognoser frem til 2030
Fremtiden for biofabrikkering i organ-on-a-chip (OoC) systemer ser ut til å være i betydelig utvikling, drevet av teknologisk innovasjon, utvidende applikasjoner, og økende etterspørsel etter fysiologisk relevante modeller i legemiddeloppdagelse og personlig medisin. Etter hvert som vi nærmer oss 2030, er flere fremvoksende muligheter og uoppfylte behov som former utviklingen av dette feltet.
En av de mest lovende mulighetene ligger i integrasjonen av avanserte biofabrikkeringsteknikker, som 3D bioprinting og mikrofluidikk, for å skape mer komplekse og funksjonelle OoC-plattformer. Disse innovasjonene gjør det mulig å oppnå presist romlig arrangement av flere celletype og ekstracellulære matriser, og gjenspeiler nært den native vevarkitekturen og funksjonen. Denne fremdriften forventes å forbedre den prediktive kraften til OoC-systemer i preklinisk testing, redusere avhengigheten av dyremodeller og forbedre oversettelsesresultater for menneskers helse.
Uoppfylte behov vedvarer, spesielt når det gjelder standardisering og skalerbarhet av biofabrikkerte OoC-enheter. Nåværende utfordringer inkluderer reproduserbarhet, langtidsholdbar celleviabilitet, og integrasjonen av sanntidssensorer. Å adressere disse problemene er kritisk for bred adopsjon i farmasøytiske og kliniske innstillinger. Bransjesamarbeid og regulatorisk engasjement, som initiativene ledet av U.S. Food and Drug Administration og European Medicines Agency, forventes å spille en avgjørende rolle i å etablere retningslinjer og valideringsrammer for disse fremvoksende teknologiene.
Markedsprognosene indikerer robust vekst for sektoren av biofabrikkerte OoC frem til 2030. Det økende fokuset på personlig medisin, sammen med behovet for mer nøyaktige sykdomsmodeller, driver investeringer fra både offentlige og private sektorer. Store aktører i bransjen, inkludert Emulate, Inc. og MIMETAS B.V., utvider sine porteføljer for å adresseres et bredere spekter av organsystemer og sykdomstilstander. I tillegg akselererer partnerskap med akademiske institusjoner og farmasøytiske selskaper oversettelsen av forskningsprototyper til kommersielt levedyktige produkter.
Ser vi fremover, forventes konvergensen mellom biofabrikkering, kunstig intelligens, og høygjennomstrømmingsscreening å åpne nye fronter innen OoC-teknologi. Disse fremskrittene vil ikke bare adressere nåværende begrensninger, men også åpne veier for applikasjoner innen regenerativ medisin, toksisitetstesting, og presisjonsterapeutikk, og posisjonere biofabrikkerte organ-on-a-chip systemer som en hjørnestein i neste generasjons biomedisinsk forskning og helsevesen.
Kilder og Referanser
- Emulate, Inc.
- MIMETAS B.V.
- National Institutes of Health (NIH)
- TissUse GmbH
- European Federation of Pharmaceutical Industries and Associations (EFPIA)
- National Institute of Biomedical Imaging and Bioengineering (NIBIB)
- Tissium
- Tissium
- F. Hoffmann-La Roche Ltd
- European Organ-on-Chip Society (EUROoCS)
- Novartis AG
- European Medicines Agency (EMA)
- ASTM International
- International Organization for Standardization (ISO)
- National Center for Advancing Translational Sciences (NCATS) Tissue Chip Program
- National Academies of Sciences, Engineering, and Medicine
- Emulate, Inc.
- European Commission
- InSphero AG